Nicht-Gleichgewichtsprozesse – ein Antrieb der Zellmaschinerie
Unabhängig davon wie Leben definiert wird, sind sich Wissenschaftler einig, dass biologische und damit lebende Systeme durch dynamische Prozesse, das heißt Veränderungen geprägt sind. Die Dynamik entsteht entweder, idem die Systeme Energie aufnehmen, oder weil sich die Systeme nicht im Gleichgewicht befinden. So kann die Konzentration einer Substanz außerhalb eines Kompartiments, also einer Zelle, größer sein als in ihrem Inneren. Dieses Ungleichgewicht erzeugt einen osmotischen Druck, der bewirkt, dass die betreffende Substanz durch geeignete Kanäle in der semipermeablen, also nur für manche Stoffe durchlässigen Membran des Kompartimentes fließt. Auf diese Weise wird der Konzentrationsunterschied diesseits und jenseits der Membran ausgeglichen und ein Gleichgewicht hergestellt. Solche Konzentrationsunterschiede liegen vielen dynamischen Prozessen in biologischen Zellen zugrunde und dienen darüber hinaus dazu, Energie zu speichern und zu nutzen. Der Ausgleich des Konzentrationsgefälles kann spontan ablaufen und benötigt keine Energie.
Andererseits sind viele biologischen Mechanismen, die in den Projekten von MaxSynBio untersucht und genutzt werden sollen, auf Energiezufuhr angewiesen. Obwohl biologische Zellen sich in großer Vielfalt in verschiedene Richtungen entwickelt haben und dabei zum Teil redundante Systeme entstanden sind (zu Minimalgenom), haben sie dennoch einige wichtige Gemeinsamkeiten. So verwenden zum Beispiel alle biologischen Zellen den gleichen genetischen Code (zu DNA und Genome herstellen) und ein paar ähnliche biochemischen Bausteine. Zu den Gemeinsamkeiten gehört auch die Form, wie sie Energie speichern und transportieren, nämlich als Adenosintriphosphat (ATP). ATP stellt die universelle Energiewährung aller biologischen Zellen dar, ähnlich einer internationalen Finanzwährung wie dem Euro. Unabhängig davon, wie ein Organismus Energie aufnimmt, sei es wie die Pflanzen in Form von Sonnenlicht oder wie andere Organismen durch Nahrung, am Ende nutzen sie die Energie in Form von ATP. So benötigt zum Beispiel der Mechanismus der Polarisierung (zu Cluster C: Nachahmung von Lebensprozessen) bei der Zellteilung genauso wie viele andere zelluläre Prozesse ATP.
Indem die Forscher von MaxSynBio zelluläre Nichtgleichgewichtsprozesse und die Energieumwandlung sowie deren Integration in künstliche Systeme untersuchen, wollen sie die Funktionen von biologischen Systemen ermöglichen.
Energieversorgung und Kofaktorregeneration
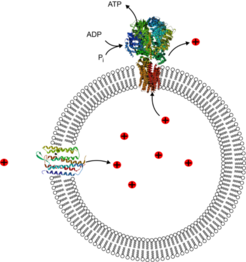
Um einen Prozess zu entwickeln, in dem ATP produziert wird, orientieren wir uns bei MaxSynBio wieder an der Natur, wobei wir unsere synthetischen Systeme viel einfacher gestalten wollen, als wir sie in der Natur beobachten.
In Pflanzenzellen sind bestimmte Zellorganellen, die Chloroplasten, für die Photosynthese zuständig, das heißt sie wandeln Lichtenergie in chemisch gespeicherte Energie in Form von ATP um. Der Prozess der Photosynthese ist ein äußerst komplexer Mechanismus, an dem zahlreiche Proteine beteiligt sind. Bei MaxSynBio wollen wir versuchen, mit nur zwei – prinzipiell sehr einfachen – Proteinen und einer künstlichen Membran, das Gleiche zu bewerkstelligen, das auch die Vorbilder aus der Natur machen: Licht in ATP umwandeln. Bei den beiden sehr unterschiedlichen Proteinen, die wir zu diesem Zweck, kombinieren möchten, handelt es sich um Bacteriorhodopsin und die ATP-Synthase
Bacteriorhodopsin ist ein lichtaktives Protein, das Licht absorbiert und einen Kanal besitzt, durch den mit der Energie des Lichts Protonen gegen ein Konzentrationsgefälle gepumpt werden können. Bacteriorhodopsin erzeugt beziehungsweise vergrößert also einen Konzentrationsunterschied an Protonen.
Setzt man Bacteriorhodopsin in die Hülle eines Mikrokompartimentes, können Protonen in dieses gepumpt werden. So entsteht ein hoher Protonendruck ähnlich einem prall gefüllten Luftballon. Baut man nun das zweite Protein, die ATP-Synthase, ebenfalls in die Hülle des Kompartimentes ein, können die Protonen durch dieses zweite Protein wieder nach außen fließen, bis der Konzentrationsunterschied an Protonen wieder ausgeglichen und das Gleichgewicht wieder hergestellt ist. Die ATP-Synthase wirkt dabei wie eine Turbine mit angeschlossenem Generator. Der Fluss der Protonen durch das Protein erzeugt mechanische Energie, die wiederum zur Produktion von ATP dient.
Proteinreaktionen in Mikrokompartimenten
Bei MaxSynBio wollen wir Mikrokompartimente mit Proteinen funktionalisieren, sodass diese ähnliche Funktionen ausüben wie rudimentäre biologische Zellen. Diese Proteine können in die entsprechenden Kompartimente eingebracht oder direkt in diesen erzeugt werden. Proteine werden anhand ihres genetischen Bauplanes exprimiert, also produziert – ein Vorgang, der in natürlichen Zellen am laufenden Band stattfindet. Möchte man nun nur diesen Expressionsmechanismus in die künstlichen Kompartimente einbringen ohne die weiteren Bestandteile der natürlichen Zelle, dann wendet man das Prinzip der zellfreien Genexpression an, die mit der zellfreien Biosynthese verwandt ist und ohne natürliche Zellen auskommt. Diese Methode der zellfreien Genexpression in Mikrokompartimenten soll genutzt werden, um in diesen Mechanismen zu etablieren, die für die genannten Nichtgleichgewichts- und Energieumwandlungsprozesse notwendig sind.
